浮遊性藍藻の分離と培養
本研究室ではアオコを形成する浮遊性藍藻の単藻培養株を確立し、詳しい形態的特性や生理的特性、遺伝情報などを調べています。 浮遊性藍藻はピペット洗浄法によって分離し、試験管で単藻培養することができます。無菌化は行っていません。
用意するもの

分離と培養に使用する器具は滅菌してから使用します。
時計皿を入れたシャーレは5枚1組にして新聞紙に包んで乾熱滅菌します(140℃、1時間)。
3-5穴の血液反応板は1枚ずつアルミホイルに包んでオートクレーブ滅菌します(121℃、20分間)。

パスツールピペットはガラス製またはステンレス製の容器に入れ、これも上と同様に乾熱滅菌します。
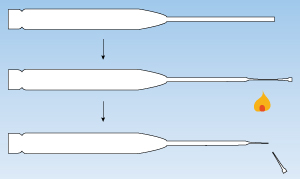
パスツールピペットは、先端をバーナーまたはガスコンロの炎で溶かし、ピンセットでつまんで引き伸ばしてから先端を折り、内径が10-100μmの筒状にします。ピペットにゴムキャップをつけます。
培地の準備

合成培地はねじ口試験管に10mlずつ入れます。
本研究室ではIchimura(下記文献参照)のC培地を使用しています(ただし、緩衝剤はHEPESを使用)。
Ichimura, T. 1971 Sexual cell division and conjugation-papilla formation in sexual reproduction of Closterium stigosum. In Proceedings of the Seventh International Seaweed Symposium, University of Tokyo Press, Tokyo, p.208-214.


培地を入れた試験管はステンレス製の試験管立てに入れてオートクレーブ滅菌します(121℃、20分間)。
分離作業

採集した試料はあらかじめ生物顕微鏡で十分に観察し、培養しようとする藻類とそれ以外のものを区別しておきます。
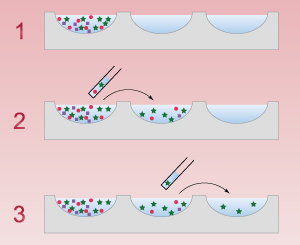
- 時計皿5枚または反応板の各穴に滅菌した培地を少量入れておきます。1番目の時計皿または反応板の穴に採集したプランクトン試料を少量入れます。
- (これ以後の作業は顕微鏡下で行います)
実体顕微鏡の下に試料の入った1番目の時計皿または反応板を置きます。反応板を使用する場合には倒立顕微鏡または生物顕微鏡を使うこともできますが、その場合は低倍率の対物レンズを使用します。 - 培養しようとする個体にピントを合わせます。ピペットで目的の個体を毛細血管現象を利用して吸い込みます。
- 吸い込んだ個体を2番目の時計皿または穴にゴムキャップを押して移します。この作業を10~20回繰り返し、目的の藻類を2番目の時計皿または穴に集めます。この時、目的の藻類以外のものが少量混じってもかまいません。
- ピペットを交換し、上と同様の作業を繰り返して2番目の時計皿または穴から3番目の時計皿または穴へ目的の藻類を移します。この作業を繰り返し、目的の藻類を3番目から4番目、4番目から5番目へと移していきます。作業を繰り返す間に、培養したい藻類以外のものは除外されていきます。
最後に、目的の藻類を1個体ずつ、培養液を入れた試験管に接種します。試験管には培養株の名称と分離した年月日を記入します。
培養室へ

この試験管を培養庫に入れて培養します。1個体から始まった培養は、順調に行けば1ヶ月もすると目に見えるほどに増えてきます。
植え継ぎ

藻類株は定期的に植え継ぎを行って培養保存します(継代培養保存)。植え継ぎは無菌室またはクリーンベンチで行います。

滅菌したパスツールピペットで増殖した藻類を少量取り、新しい培地に移します。

本研究室の培養庫の温度は18℃または20℃、照明は白色蛍光灯を使い、1500または3000ルックス、日照時間は8時間明期:16時間暗期または12時間明期:12時間暗期としています。培養の温度を上げたり、日照時間(明期)を長くすると増殖が速くなります。