| ホーム ≫ 研究と標本・資料 ≫ 標本・資料データベース ≫ フラボノイドコレクション ≫ データの見方 |
データの見方
紫外・可視吸収スペクトル
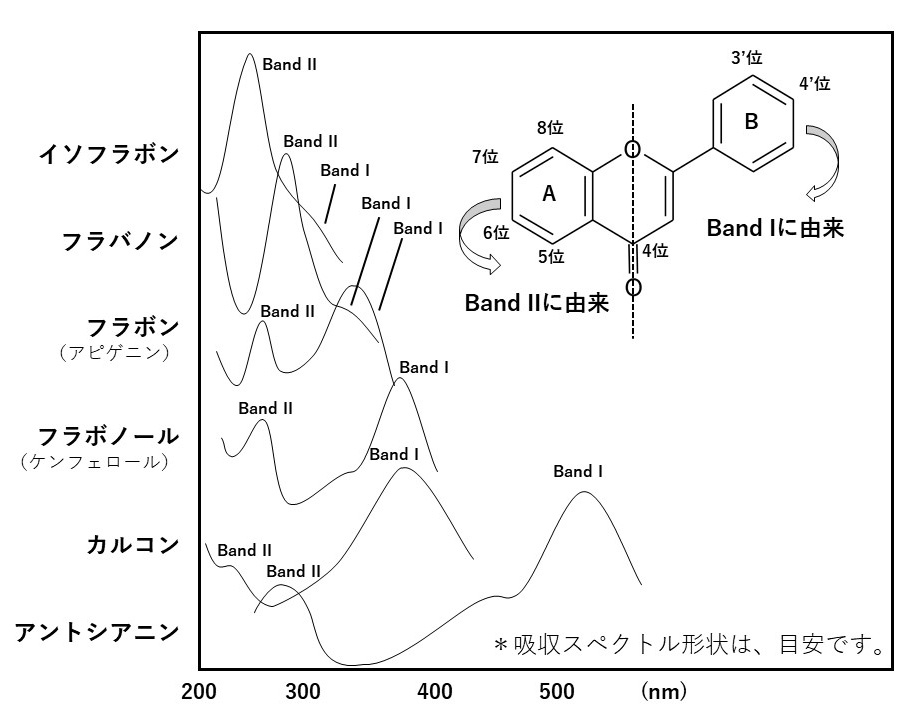
フラボノイドは紫外線領域~可視領域(190~700 nm)に2か所の吸収帯をもちます。フラボノイドの吸収曲線や吸収極大の位置はフラボノイドの種類によって異なっており、おおまかに識別することができます(第1図、第1表)。
長波長側をBand Ⅰ、短波長側をBand Ⅱといいます。Band Ⅰは主にB環を含むシンナモイル系、Band ⅡはA環のベンゾイル系に由来する吸収です。
| フラボノイド | メタノール溶液中 | |
| BandⅠ | BandⅡ | |
| イソフラボン | ||
|---|---|---|
| ゲニステイン | 328sh | 261 |
| ダイゼイン | 313sh | 256 |
| フラバノン | ||
| ナリンゲニン | 326sh | 289 |
| フラボン | ||
| アピゲニン | 336 | 267 |
| アピゲニン7-O-グルコシド | 333 | 268 |
| ルテオリン | 349 | 267, 253 |
| ルテオリン7-O-グルコシド | 348 | 265sh., 255 |
| アカセチン | 327 | 269 |
| ペクトリナリゲニン | 330 | 274 |
| フラボノール | ||
| ケンフェロール | 367 | 266 |
| ケンフェロール 3-O-グルコシド | 347 | 266 |
| ケンフェロール 7-O-グルコシド | 364 | 266 |
| ケルセチン | 370 | 269sh., 255 |
| ケルセチン 3-O-グルコシド | 358 | 266sh., 257 |
| ケルセチン 3-O-ルチノシド | 359 | 266sh., 257 |
| ケルセチン 3-O-(アセチルグルコシド) | 356 | 266sh., 256 |
| ケルセチン 3-O-(カフェイルグルコシド) | 333 | 254 |
| ケルセチン3-O-(ガロイルグルコシド) | 355 | 266 |
| ミリセチン | 374 | 272sh., 254 |
| ミリセチン3-O-グルコシド | 364 | 264sh., 257 |
| フラボノイド | メタノール溶液中 | |
| BandⅠ | BandⅡ | |
| C-グリコシルフラボン | ||
|---|---|---|
| イソビテキシン | 333 | 271 |
| イソオリエンチン | 350 | 270, 257 |
| カルコン | ||
| イソリキリチゲニン | 367 | 258sh. |
| カルコノナリンゲニン 2'-O-グルコシド | 368 | 248sh. |
| カルコノナリンゲニン 4-O-グルコシド | 356 | 232sh. |
| ブテイン | 382 | 263 |
| ブテイン 4'-O-グルコシド | 385 | 265 |
| オーロン | ||
| スルフレチン | 395 | 257 |
| オーロイシジン4,6-O-ジグルコシド | 408 | 254sh. |
| アントシアニン* | ||
| ぺラルゴニジン 3-O-グルコシド | 512 | 272 |
| シアニジン 3-O-グルコシド | 529 | 281 |
| ペオニジン 3-O-グルコシド | 529 | 280 |
| デルフィニジン 3-O-グルコシド | 541 | 277 |
| ペチュニジン 3-O-グルコシド | 539 | 278 |
| マルビジン 3-O-グルコシド | 539 | 279 |
| マルビジン 3,5-O-ジグルコシド | 535 | 276 |
実際には、測定値に若干のずれが生じる可能性があります
*アントシアニンのみ0.01%塩酸を含むメタノール溶液で測定
sh.=ショルダーピーク
フラボン・フラボノール
ケンフェロールやケルセチンのようなフラボノールは340~370 nmの間にBand Ⅰが、250~270 nmの間にBand Ⅱがあります。アピゲニンやルテオリンのようなフラボンのBand Ⅱはフラボノールとほぼ変わりませんが、Band Ⅰは320~350 nm付近のより短波長側に見られます。Band ⅠとⅡの位置は、それぞれ助色団として機能するヒドロキシ基の数が多いほど長波長側に出現します。ヒドロキシ基が糖やメチル基で置換された場合は、ヒドロキシ基が存在しない状態に近くなります。また、6位や8位にヒドロキシ基をもつフラボノイドもありますが、これらのほうが、Band Ⅱはより長波長側に見られます。C-配糖体(6位や8位に糖が結合)の場合も、Band Ⅱはより長波長側に出現します。芳香族有機酸の結合は有機酸のスペクトル特性を元の配糖体にあわせた吸収曲線を示します。脂肪族有機酸の結合はスペクトル特性を変化させません。
アントシアニン
アントシアニンは0.01%塩酸メタノール中で、紫外部(Band II)と可視部(Band I)にそれぞれ吸収極大が見られます。Band Iは500~540 nmに見られ、橙から赤、紫色を呈します。また、5位のヒドロキシ基に糖が結合すると、400~460 nmの波長域の吸光度に差が見られます。芳香族有機酸が結合した場合には、有機酸のスペクトル特性をあわせた吸収曲線になります。
カルコン・オーロン
カルコンとオーロンは通常、可視域に近い360~400 nmにBand Ⅰの吸収極大があり、黄色色素として機能します。オーロンの方がBand Ⅰは長波長側に位置します。Band Ⅱはいずれも240~260 nm付近で、小さいかあるいは、ショルダーとして出現します
イソフラボン
250 nm付近に大きなBand IIが出現し、Band Iは320 nm前後にかなり小さいか、ショルダーとなって出現します。
フラバノン
イソフラボンと類似した吸収曲線を示しますが、Band IIは280 nm付近に出現します。
各種試薬の添加による紫外・可視吸収スペクトル
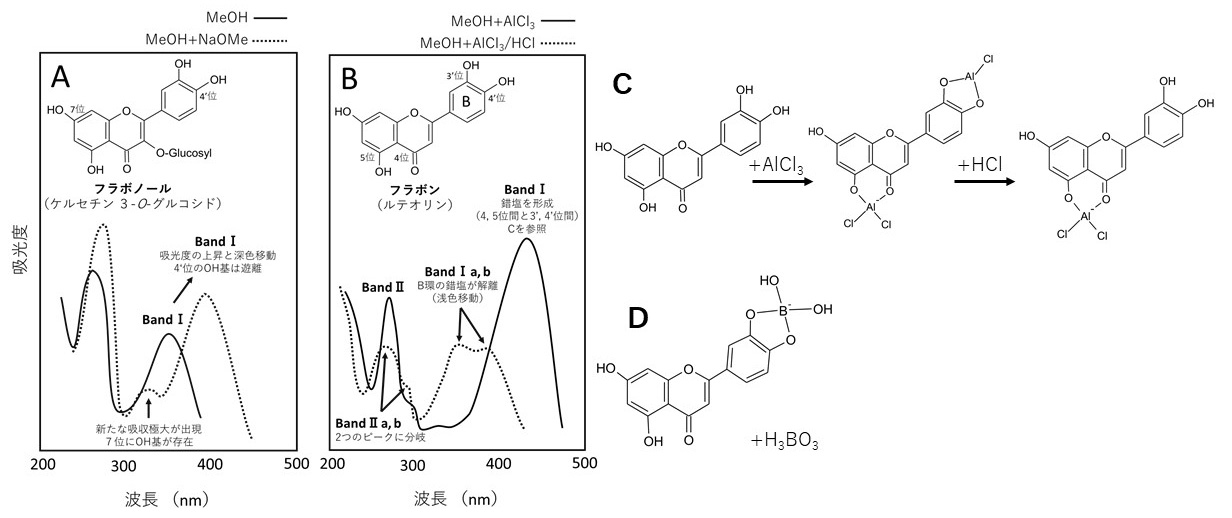
構造決定のために、フラボンやフラボノール、カルコン、オーロンなどでは、メタノール溶液に試薬を添加し、吸収曲線の変化を調査することで、構造情報が得られます(第2図、第2表)。アントシアニンでは、0.01%塩酸メタノール溶液に塩化アルミニウムの添加を行うことで、隣接するヒドロキシ基に関する手掛かりを得ることもあります。一方、フラバノンやイソフラボンでは吸収曲線の特性からは構造について、多くの情報を得られません。
A. ナトリウムメチラート(NaOMe)
フラボノイド溶液はアルカリ性になると、ヒドロキシ基がほとんど解離するため、遊離のヒドロキシ基を有するフラボノイドは吸収極大が長波長側に移動します(深色移動)。3位と4ʹ位に遊離のヒドロキシ基がある場合には、分解も生じます。すなわち、分解が生じない場合は3位か4ʹ位のどちらか、あるいは両方のヒドロキシ基がグリコシル化やメチル化されていることになります。
3位と4ʹ位のグリコシル化やメチル化はBand Ⅰを見て判断できます。NaOMeを添加した際のBand Ⅰが、メタノールのみで測定したものより深色移動し、吸光度が増加した場合は、4ʹ位のヒドロキシ基は遊離です。一方、吸光度が顕著に減少した場合は、4ʹ位または、3位と4ʹ位の両方がグリコシル化あるいはメチル化されていると考えられます。
7位のヒドロキシ基については、置換されていない場合、Band ⅠとⅡの間に新しい吸収極大が出現します(第2図A)。
【実験方法】:市販のナトリウムメチラート(28%ナトリウムメチラートメタノール溶液)を用いて、フラボノイドのメタノール溶液に3滴程度加え、測定をします。水酸化ナトリウム溶液でも同様の変化が生じます。
B. 塩化アルミニウム(AlCl3)と塩酸(HCl)
4位にカルボニル基を持つフラボノイドは隣接する3位や5位に遊離のヒドロキシ基が存在すると、AlCl3と錯塩を形成します。この錯塩はきわめて安定で、HClを加えても、アルミニウムは遊離しません(第2図C)。錯塩は隣接したヒドロキシ基の間でも形成されますが、3ʹ位と4ʹ位や6位と7位の錯塩は不安定で、HClを添加すると遊離します(第2図C)。フラボノイドは錯塩を形成すると吸収極大が深色移動するため、AlCl3を加えたものと、それにHClを加えたものの吸収を比較することで、構造を把握することができます(第2図B)。例えば、ルテオリンの場合、5位のヒドロキシ基と4位のカルボニル基およびB環の3ʹ位と4ʹ位のヒドロキシ基の両方で錯塩が形成されます。この時、メタノール溶液中で測定された吸収極大よりBand Ⅰが65∼90 nmほど長波長側に移動しますが、これにHClを加えるとヒドロキシ基間の錯塩だけが解離し、30∼40 nmほど短波長側に戻ります(浅色移動)。またこの時、Band ⅠとⅡはそれぞれ2つのピークに分かれます(Band Ia, IbおよびBand IIa, IIb)。一方、アピゲニンのようにB環に隣接するヒドロキシ基を持たないものはAlCl3の添加で深色移動が生じますが、HClでも顕著な浅色移動は生じません。
【実験方法】:5gの無水AlCl3を100mlのメタノールに溶かします。この溶液を5~6滴メタノール溶液に加え、スペクトルを測定します。
C. 酢酸ナトリウム(NaOAc)とホウ酸(H3BO3)
NaOAcは弱いアルカリ性のため、フラボンやフラボノールでは、やや強い酸性である3、7、4ʹ位のヒドロキシ基をイオン化します。このため、7位に遊離のヒドロキシ基を有する場合はBand Ⅱに、3位や4ʹ位にヒドロキシル基を有するものはBand Ⅰに深色移動が生じます。ただし、6位や8位にも遊離のヒドロキシ基が存在する場合は、ほとんど移動しなくなります。
H3BO3は隣接する遊離のヒドロキシ基が存在する場合に錯塩を生じます(第2図D)。一方、4位にカルボニル基が存在するものでは、5位のヒドロキシ基と4位の間で水素結合が生じており、錯塩は形成されません。B環(一般的には3ʹ位と4ʹ位)に隣接するヒドロキシ基が存在する場合、Band Ⅰに12~30 nm、A環の場合は、5~10 nmの深色移動が見られます。
カルコンとオーロンでは、B環に隣接する遊離のヒドロキシ基が存在すれば、Band Ⅰが深色移動します。
【実験方法】:無水NaOAcの粉末を加え、測定を行います。測定を行った溶液に無水H3BO3を加え、スペクトル測定を行います。NaOMeの添加で、分解が生じた試料では、NaOAcを添加してスペクトルを測定した試料は廃棄し、新たにフラボノイド溶液メタノールにH3BO3を飽和させた溶液を5滴程度加えNaOAcの粉末を添加し、スペクトル測定を行います。
- A:ケルセチン3-O-グルコシドのメタノール溶液中(MeOH)およびナトリウムメチラート(NaOMe)添加時の吸収曲線
- B:ルテオリンのMeOH溶液に塩化アルミニウム(+AlCl3)および塩酸(+AlCl3/HCl)を添加した際の吸収曲線
- C:ルテオリンのMeOH溶液に塩化アルミニウム(+AlCl3)および塩酸(+AlCl3/HCl)を添加した際の錯塩の形成
- D:ルテオリンのMeOH溶液にホウ酸(+H3BO3)を加えた際の錯塩の形成
| フラボノイド | +ナトリウムメチラート (NaOMe) |
+塩化アルミ (AlCl3) |
+AlCl3/塩酸 (HCl) |
+酢酸ナトリウム (NaOAc) |
+NaOAc/ホウ酸 (H3BO3) |
|||||
| BandⅠ | BandⅡ | BandⅠ | BandⅡ | BandⅠ | BandⅡ | BandⅠ | BandⅡ | BandⅠ | BandⅡ | |
| フラボン | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| アビゲニン | 336 inc. | 267 | 384, 348 | 301, 276 | 381, 340 | 299, 276 | 376 | 274 | 338 | 268 |
| *アビゲニン7-O-グルコシド | 378 inc. | 272 | 381, 348 | 299, 275 | 381, 340 | 298, 276 | 387 | 267 | 339 | 268 |
| ルテオリン | 401 inc. | 329, 266 | 426 | 274 | 385, 355 | 294sh., 275 | 384 | 269 | 370 | 259 |
| ルテオリン7-O-グルコシド | 389 inc. | 266 | 427 | 273 | 386, 358 | 295sh., 275 | 404 | 260 | 373 | 260 |
| フラボノール | ||||||||||
| ケンフェロール | 416 inc. | 316, 278 | 424, 350 | 303sh.,268 | 424, 348 | 303sh., 269 | 387 | 274 | 372 | 267 |
| ケンフェロール 3-O-グルコシド | 396 inc. | 325, 275 | 393, 348 | 304sh., 275 | 394, 347 | 303, 275 | 383 | 274 | 348 | 267 |
| ケルセチン | decomp. | decomp. | 458 | 272 | 428, 359 | 301sh., 265 | 390 | 274 | 388 | 261 |
| ケルセチン 3-O-グルコシド | 409 inc. | 329, 273 | 433 | 275 | 399, 362 | 298, 269 | 394 | 273 | 378 | 261 |
| C-グリコシルフラボン | ||||||||||
| イソビテキシン | 399 inc. | 278 | 378sh., 348 | 303, 278 | 377sh., 344 | 301, 279 | 394 | 278 | 347 | 272 |
| イソオリエンチン | 412 inc. | 269 | 425 | 275 | 385sh., 359 | 296sh., 277 | 401 | 272 | 379 | 267 |
*本データベースでは、例えば、アビゲニン7-O-グルコシドの場合は、「UVλmax (nm): MeOH 268, 333; +NaOMe 272, 378 (inc.); +AlCl3 275, 299, 348, 381; +AlCl3/HCl 276, 298, 340, 381; +NaOAc 267, 387; +NaOAc/H3BO3 268, 339」と表記しています
実際には、測定値に若干のずれが生じる可能性があります
sh.=ショルダー、inc.=increase (吸光度の増加)、decomp.=decomposition(経時的に吸収曲線が変化する)